- HOME
- 分野別ソリューション
- バイオ医薬品および医薬品
- 遺伝子治療と送達システム
- ウイルスベクターの特性解析
アデノ随伴ウイルス(AAV)はノンエンベロープウイルスであり、DNA をターゲット細胞に導入するように操作できます。AAV ベクターは、ウイルス遺伝子が欠落して目的の DNA 配列を含む遺伝子組み換え型 AAV 粒子を生成できるため、遺伝子治療の主要なプラットフォームとなっています。1 この分野は進歩を続けていますが、トランスジェニック発現の効率、製造の容易さ、安全性、毒性、および安定性に関連する課題は依然として残っています。
米国食品医薬品局(FDA)は、特に複数の血清型変異体や組み換え変異体を産生する施設において、リリース前にすべての AAV 製品を明確に同定するよう求めています。2 アジレントが提供する分析ソリューションは、優れた速度、特異性、精度でインタクトタンパク質とペプチドマッピングを分析でき、翻訳後修飾(PTM)の同定と部位決定が可能です。
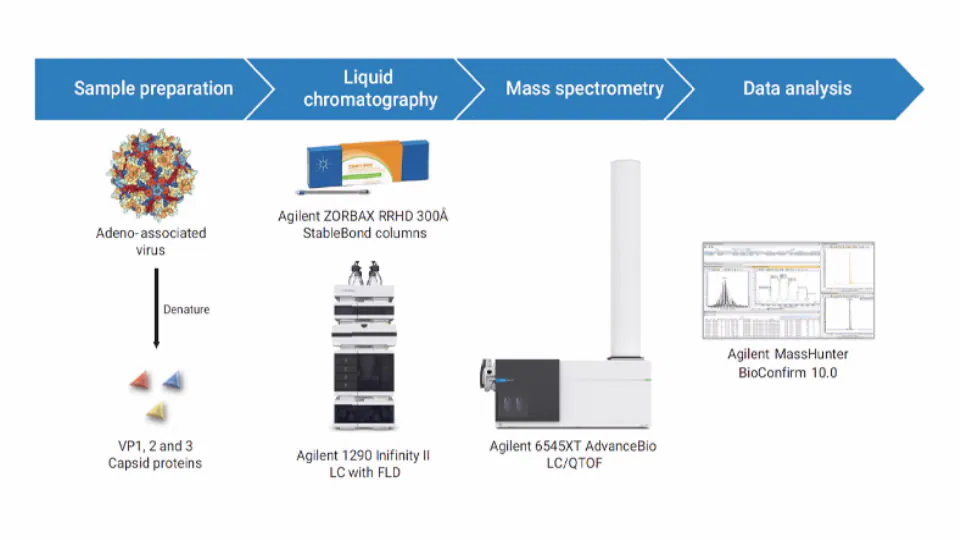
AAV 特性解析ワークフローにおける信頼性向上と重要品質特性(CQA)のモニタリング
AAV は、タンパク質カプシドとカプセル化された DNA で構成される大きな分子複合体であり、製品全体の品質と安全性を確保するためには、個々の AAV に専用の分析技術が必要とされます。AAV カプシドは、一般に VP1、VP2 および VP3 と呼ばれる 3 種類のカプシドタンパク質を、約 1:1:10 の化学量論比で含み、カプシドあたり合計 60 コピーのタンパク質で構成されます。原則として、LC/MS により、ウイルスカプシドタンパク質分析の速度と特異性の最適な組み合わせが得られます。なぜなら、タンパク質の質量を直接測定することで、AAV の各タイプに対して抗体を生成する必要がなくなるからです。ただし、これまでの検討には、ウイルスカプシドタンパク質のクロマトグラフィー分離が比較的不十分という問題点がありました。これは、AAV 感染性の重要な決定要因であるカプシドの化学量論を正確に定量できず、さらに共溶出がシグナル強度と質量精度を損なう可能性があるという問題があります。
このアプリケーションノート では、Agilent 1290 Infinity III LC システム、 6545XT AdvanceBio LC/Q-TOF、および ZORBAX RRHD 300 Å カラム が、最適化された LC/FLD/MS メソッドを用いて、AAV カプシドタンパク質を迅速に分析し、7 種類の異なる血清型の一次配列を確認した例について紹介します。
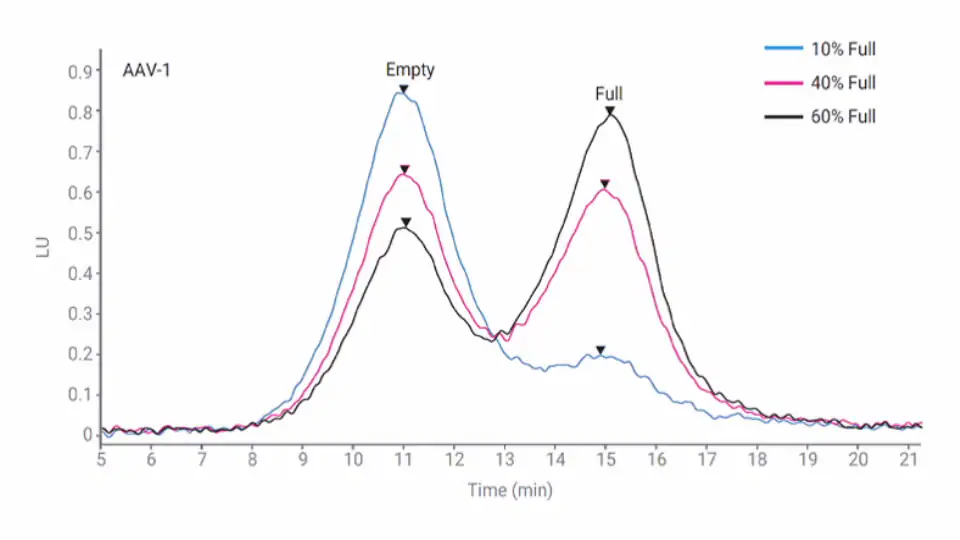
遺伝子組み換え型 AAV の製造時、大部分のウイルスカプシドには遺伝子ペイロードが含まれていないため、「空」のカプシドと呼ばれています。空のカプシドは AAV 前処理の遺伝子形質導入の効能を低下させるため、規制機関は特性解析が必要な工程内不純物であると考えています。
この アプリケーションノートでは、Agilent 1290 Infinity II Bio LC と Bio SAX 強アニオン交換カラム を用いて、精製された AAV-1 および AAV-6 サンプル中の完全/空のカプシド比を測定した例について紹介します。
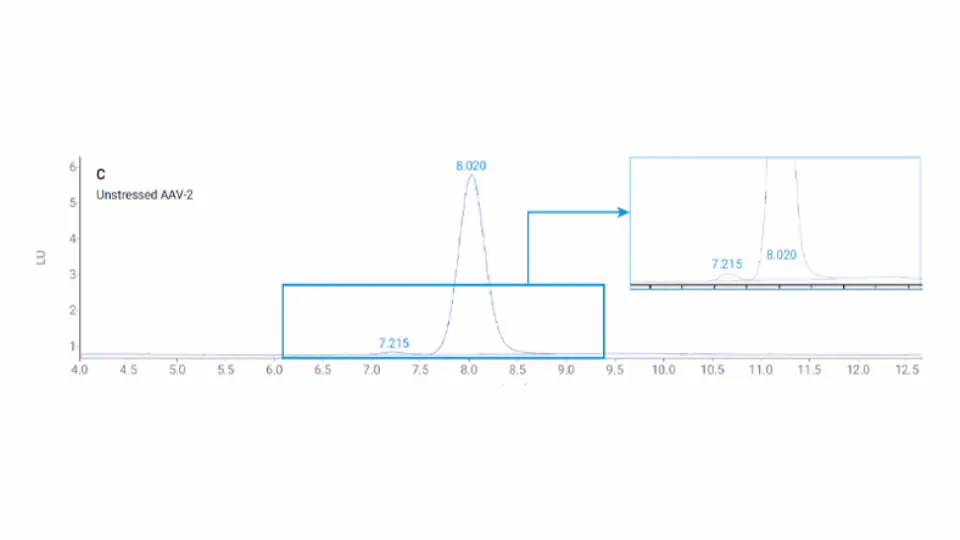
AAV は、一本鎖 DNA ゲノムをカプセル化するカプシドタンパク質の約 60 コピーからなる大きな分子複合体です。AAV 凝集体およびフラグメントの分析は、AAV の精製とその後の製剤安定性試験に不可欠です。個々の AAV ビリオンは 5 MDa1 を超える場合があり、サイズは約 250 Å です。したがって AAV 凝集体は、ポアサイズが通常は 300 Å 以下の標準的なサイズ排除クロマトグラフィー(SEC)カラムを使用して分離するのは困難です。これまでの知見から、SEC では目的の分子よりも少なくとも 3 倍大きいポアサイズを選択する必要があるとされているため、この場合のポアサイズは 750 Å 以上となります。
この アプリケーションノート では、Agilent1290 Infinity II Bio LC と Bio SEC-5 カラムを、ポアサイズが 1,000 Å の AAV 凝集体およびフラグメントのクロマトグラフィー分離に用いた例について紹介します。
アデノ随伴ウイルス(AAV)およびウイルスベクターの分析
脂質ナノ粒子分析
関連アプリケーション/資料